アルツハイマー病新薬、米FDAが20年ぶり承認 日米企業が共同開発
米食品医薬品局(FDA)は7日、米製薬会社バイオジェンと日本の製薬会社エーザイが共同開発したアルツハイマー病の治療薬「アデュカヌマブ」を承認した。アルツハイマー病の新薬承認は約20年ぶり。
アデュカヌマブは、もっとも一般的な認知症であるアルツハイマーの症状ではなく、その根本的な原因に作用するとされる。
アルツハイマー病の新たな治療法の承認に、慈善団体からは歓迎の声が上がっている。
一方で科学者の間では、臨床試験結果の不確実性から、同薬の効果について意見が割れている。
イギリスの規制当局が同薬を承認した場合、同薬は少なくとも10万人の軽度の患者の治療に適するとみられる。
FDAは、「アデュカヌマブが脳内のアミロイドβ(ベータ)プラークを減少させるという実質的証拠がある」とし、「患者に重要な利益をもたらすことが合理的に予想される」と説明した。
物議を醸した臨床試験
約3000人の患者が参加したアデュカヌマブの国際的な後期臨床試験では、同薬を月1回投与された患者に、偽薬を投与された患者よりも記憶や思考の問題の悪化を遅らせる効果はみられないとの分析結果が出た。そのため、2019年3月に臨床試験が中止された。
しかし同年末、バイオジェンはより多くのデータを分析し、より高用量で投与すれば薬が有効であると結論付けた。また、認知機能の低下を大幅に抑制したとした。
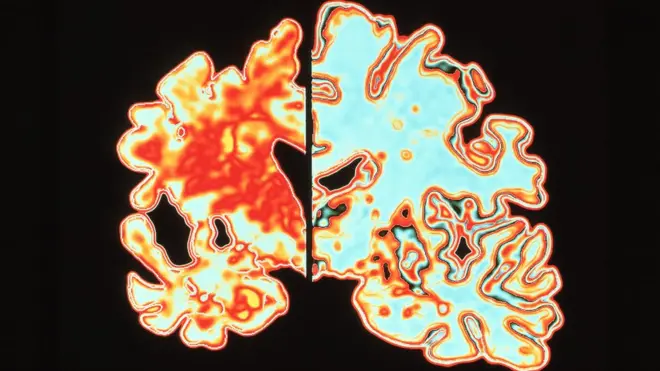
アデュカヌマブは、アルツハイマー病患者の脳内で異常な塊を形成して細胞を傷つけ、記憶力や思考力の低下、コミュニケーションの問題や錯乱といった認知症の症状を引き起こすたんぱく質アミロイドを標的とする。
「非常に重要な節目」
アルツハイマー病患者は世界中に3000万人以上いるとされ、そのほとんどは65歳以上だ。
イギリスでは約50万人がアルツハイマー病を発症している。アデュカヌマブが承認されれば、投与対象となるのはほとんどが60代あるいは70代の、病気の初期段階の人たちとなる。
英国認知症研究所の所長バート・ド・ストルーパー教授は、アデュカヌマブの承認はアルツハイマー病の治療法を模索する上で「非常に重要な節目」だと述べた。
過去10年間で100以上のアルツハイマー病治療薬の候補の開発が失敗に終わっている。
ストルーパー教授は、今回の承認がアルツハイマー病を患う何百万人もの人々にとって転換点となることを期待するとしつつ、「乗り越えるべき障壁はまだ多く残されている」と述べた。
英ユニバーシティ・コレッジ・ロンドンの神経科学教授、ジョン・ハーディ氏は、「この薬はせいぜい、非常に注意深く選ばれた患者にわずかな効果しかないものだということを明確にしておかなければならない」と述べた。

新薬承認は「重大な誤り」
ユニバーシティ・コレッジ・ロンドンの老年精神医学教授、ロバート・ハワード氏は、同薬の承認は「重大な誤り」であり、意味のある認知症治療法を求めて進められている研究を「10年」妨げる恐れがあると指摘した。
ハワード教授は、認知機能の低下を遅らせることができなかったという臨床試験データをFDAが無視したと述べた。
一方で慈善団体「Alzheimer's Society」は、新薬は「期待が持てるもの」だとしつつ、「アルツハイマー病の新しい治療法への道のりが始まったに過ぎない」と付け加えた。
別の慈善団体「Alzheimer's Research UK」は、マット・ハンコック英保健相に対し、イギリスでのアデュカヌマブの迅速な承認プロセスを優先するよう求める文書を提出したと明かした。
同団体代表のヒラリー・エヴァンス氏は、「認知症の人とその家族は、人生を変えるような新しい治療法をあまりにも長い間待ち続けている」と述べた。
「規制当局がイギリスでこの薬を安全に効果的に使用できるかどうか、証拠の評価を進めることが不可欠だ」
多くの医師がアデュカヌマブの効果を疑問視しているが、アメリカでの使用承認は、がんや心臓病に比べてもともと資金不足に見舞われてきた認知症研究を大きく後押しすることになるだろう。