難病ハンチントン病の治療に成功、世界初 進行が75%遅くなったと英研究チーム

画像提供, BBC/Fergus Walsh
ジェイムズ・ギャラガー保健・科学担当編集委員
最も残酷な難病の一つとされるハンチントン病の治療に、イギリスの医療チームが世界で初めて成功した。
ハンチントン病は遺伝性で、容赦なく脳細胞を死滅させる。認知症やパーキンソン病、運動ニューロン疾患を組み合わせたような症状が特徴だ。
BBCが取材した研究チームは、患者の病気の進行が75%遅れたことを示すデータについて説明する際、感極まって涙を流した。サラ・タブリジ教授は、「通常は1年で予想される進行が、治療後には4年に延びた。これは、患者に数十年にわたる『良質な生活』をもたらす」と語った。
新たな治療法は一種の遺伝子治療で、12〜18時間に及ぶ繊細な脳外科手術によって行われる。
ハンチントン病の最初の症状は、30代または40代で現れる傾向があり、通常は20年以内に死に至る。そのため、より早く治療を開始すれば、そもそも症状が現れない可能性が開けた。
英ユニバーシティ・コレッジ・ロンドンのハンチントン病センターの所長を務めるタブリジ教授は、今回の結果を「劇的だ」と表現した。
「臨床的進行が75%も遅れるとは、夢にも思わなかった」
治療を受けた患者の氏名は公表されていないが、医療上の理由で仕事を辞めていた1人は復職したという。治験に参加している他の患者も、車椅子が必要になると言われていたが、現在も自力で歩いている。
治療費は非常に高額になる可能性がある。しかし、ハンチントン病は人生の最盛期に人々を襲い、患者の家族を打ちのめす病のため、今回の成果は真の希望の瞬間だ。

画像提供, BBC/Fergus Walsh
ジャック・メイ=デイヴィスさんは、ハンチントン病の遺伝を持つ家系に生まれ、この病を引き起こす遺伝子の変異を持っている。父親のフレッドさんも、祖母のジョイスさんも同様だった。
ジャックさんは、父親が容赦なく衰えていく様子を見守ることが「本当にひどく、恐ろしかった」と語った。
フレッドさんに最初の症状が現れたのは30代後半で、行動や動作の変化が見られた。最終的には24時間体制の緩和ケアが必要となり、2016年に54歳で亡くなった。
ジャックさんは現在30歳で、法廷事務官として働いており、クローイさんとの婚約を発表したばかりだ。ジャックさんは、自身の診断を前向きなものに変えるため、ユニヴァーシティ・コレッジ・ロンドンでの研究に参加している。
これまでジャックさんは常に、自分も父親と同じ運命をたどることになると理解していたという。
しかし現在、ジャックさんは「まったく信じられない」ほどの進展に「圧倒されている」と述べ、未来が「少し明るく見えるようになった。自分の人生がもっと長くなるかもしれないと考えられるようになった」と語った。

画像提供, May-Davis family
ハンチントン病は、ハンチンチン遺伝子と呼ばれるDNAの一部に変異が生じて引き起こされる。
両親のいずれかがハンチントン病を患っている場合、変異した遺伝子を受け継ぎ、最終的にハンチントン病を発症する確率は50%だ。
この変異は、脳に必要なハンチンチンたんぱく質を、神経細胞を死滅させる物質へと変えてしまう。
治療では、この有害なたんぱく質の量を、1回の投与によって永久的に減少させる。
この治療法は、遺伝子治療と遺伝子サイレンシング技術を組み合わせた、最先端の遺伝医学を用いているという。
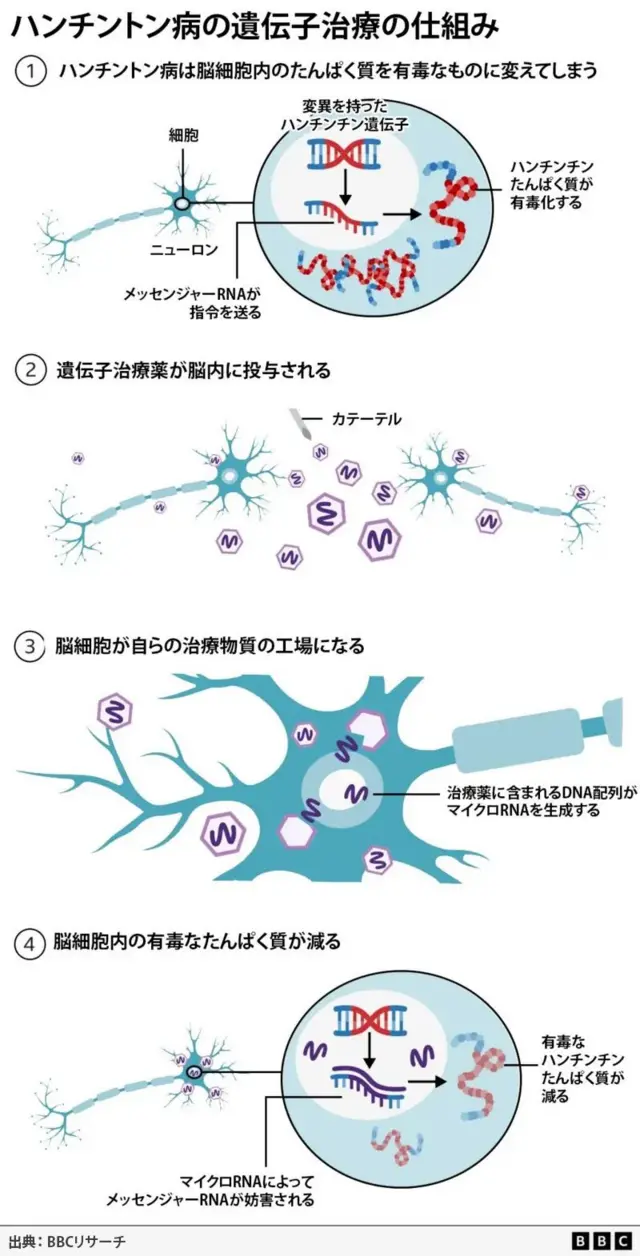
治療は、安全なウイルスを改変し、特別に設計されたDNA配列を組み込むことから始まる。
そしてリアルタイムのMRI(磁気共鳴断層撮影)技術を使い、マイクロカテーテルを脳の2か所の領域(尾状核と被殻)へと誘導しながら、このウイルスを脳の深部に注入する。この処置には、12〜18時間の脳神経外科手術が必要だ。
その後、ウイルスは小さな郵便配達人のように働き、脳細胞の内部に新たなDNA配列を届ける。そこで新たなDNAが活性化すると、脳細胞は自らの死を回避するための治療物質を生成する工場へと変化する。
脳細胞は、マイクロRNA(マイクロ・リボ核酸、miRNA)と呼ばれる小さな遺伝物質の断片を生成する。このマイクロRNAは、細胞のDNAから送られてくる変異型ハンチンチンを構築するためのメッセンジャーRNA(mRNA)を妨害し、無効化するよう設計されている。
その結果、脳内の変異型ハンチンチンの量が減少する。
画像提供, UCLH
今回、29人の患者が参加した治験の結果が、遺伝子治療企業ユニキュア(uniQure)による声明として公表された。ただし、他の専門家による査読を受ける形での全文公開はまだ行われていない。
データによると、手術から3年後、認知機能と運動機能、日常生活の自立度を組み合わせた指標に基づき、病気の進行が平均で75%遅れたことが示された。
また、治療が脳細胞を保護していることも明らかになった。脳細胞の死滅を示す明確な指標である脊髄液中のニューロフィラメント(神経細糸)の量は、病気が進行していれば約30%増加するはずだったが、実際には治験開始時よりも低下していた。
ユニヴァーシティ・コレッジ・ロンドン病院で神経内科コンサルタントを務めるエド・ワイルド教授は、「これこそが我々が待ち望んでいた結果だ」と述べた。
「このような結果が得られる可能性はほとんどないと思っていた。だからこそ、これが現実となり、その効果の大きさが息をのむほどであることを知った今、その感情を完全に言葉にするのは非常に難しい」
ワイルド教授は、この治療が、多くの家族に与える影響を考えると「少し涙ぐんでしまう」とも述べた。
この治療は安全と見なされているが、一部の患者にはウイルスによる炎症が生じ、頭痛や混乱を引き起こした。これらの症状は自然に解消されたか、ステロイド治療を必要とした。
ワイルド教授は、脳細胞は血液や骨、皮膚のように体内で常に再生されるわけではないため、この治療は「一生持続するはずだ」との見通しを示した。
イギリスとアメリカ、ヨーロッパには、ハンチントン病の患者が約7万5000人いる。さらに数十万人がこの変異を保有しており、将来的に発症することになる。
ユニキュアは、2026年第1四半期にもアメリカで承認申請を行い、同年中の治療薬発売を目指すとしている。イギリスおよびヨーロッパの当局との協議は来年開始される予定だが、当面の焦点はアメリカ市場に置かれている。
同社の最高医療責任者を務めるワリド・アビ・サーブ博士は、今回の結果が家族にとって何を意味するかについて「非常に興奮している」と述べ、治療には「ハンチントン病を根本的に変える可能性がある」と付け加えた。
ただし、この治療は非常に複雑な手術を伴うことや、予想される高額な費用のため、すべての人が利用できるわけではない。
「間違いなく高額になるだろう」と、ワイルド教授は語った。
治療薬の正式な価格はまだ決まっていない。遺伝子治療は一般的に高価だが、その長期的な効果により、費用対効果の面で妥当とされる場合もある。イギリスでは、NHS(国民保健サービス)が血友病Bに対する1人あたり260万ポンド(約5億2000万円)の遺伝子治療費を負担している。
タブリジ教授は、この遺伝子治療について「始まりにすぎない」と述べ、より多くの人々に届く治療法への道を開くものだと語った。
また、治験に参加した「本当に勇敢な」ボランティアたちに敬意を表し、「患者とその家族のために非常にうれしく思っている」と述べた。
タブリジ教授はすでに、遺伝子を保有しているがまだ症状が現れていない、いわゆる「ステージゼロのハンチントン病」の若者たちとも研究を進めており、病気の進行を大幅に遅らせる、あるいは完全に止めることが可能かどうかを検証する初の予防治験を目指している。