درخواست صدور مجوز اضطراری برای واکسن برکت

منبع تصویر، Tasnim
مینو محرز، عضو ستاد علمی بررسی واکسن "کوو ایران برکت" خواستار صدور مجوز مصرف اضطراری برای این واکسن شد و گفت که "بیش از انتظار ما ایمنیزایی داشته است".
خانم محرز در یک نشست خبری برای تشریح فاز سوم کارآزمایی بالینی واکسن برکت گفت که "مراحل کارآزمایی بالینی پروژه واکسن ایرانی کرونا تحت نظارت افراد علمی و بالاتر از استانداردهای ملی انجام شد."
به گفته وی این واکسن "فازهای حیوانی پشت سر گذاشته شد و ایمنی واکسن در فاز انسانی نیز به اثبات رسید".
این عضو ستاد مقابله با کرونا ایران میگوید که "به عنوان مجری و ناظر این کارآزمایی بر روند مطالعه نظارت" داشته "به شما نوید میدهیم که واکسن برکت مصون و موثر است".
مرحله سوم آزمایش انسانی واکسن کرونای ساخت داخل با نام "کوو ایران برکت" ۵ اردیبهشت در ایران آغاز شده بود و قرار بود ۲۰ هزار نفر در آن شرکت کنند.
حسن جلیلی از دستاندرکاران تولید این واکسن نیز گفت که تا خردادماه ۴ میلیون دوز از این واکسن تولید شده و از شهریور این رقم به ۱۸ میلیون دوز خواهد رسید.
پیشتر مقامهای مختلف ایران بارها اعلام کردند که ساخت و تولید حداقل هشت واکسن کرونا در "دوازده شرکت دانشبنیان" را با استفاده از فناوریهای گوناگون و پیشرفته پیش میبرند.
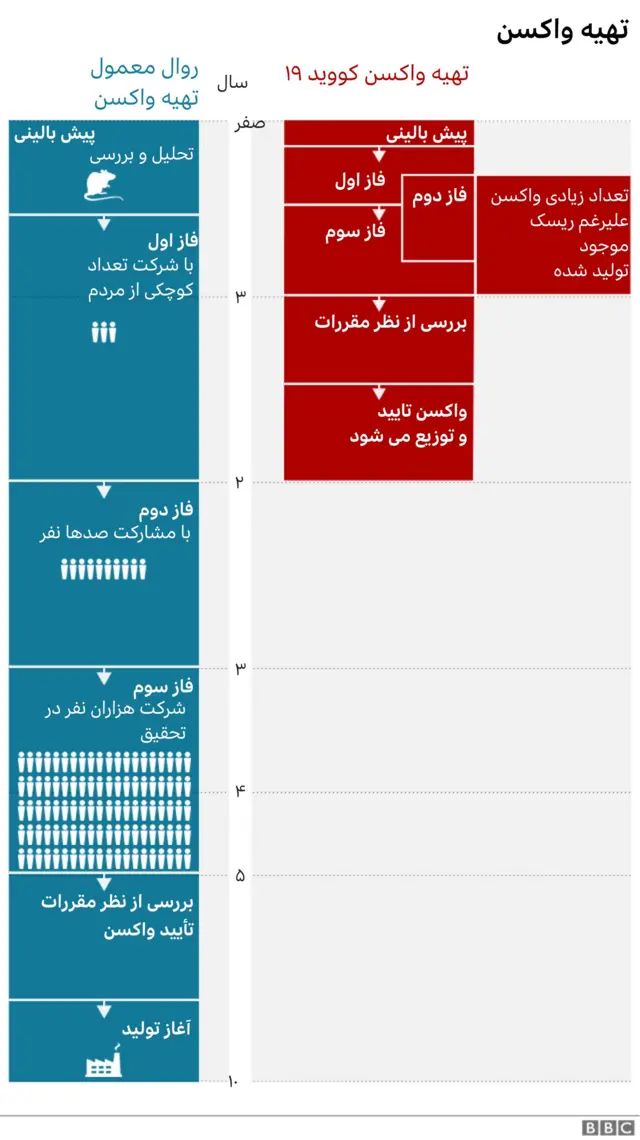

مراحل تولید واکسن بطور خلاصه:
۱. انتخاب فناوری برای طراحی و ساخت واکسن، برای مثال استفاده از فناوری ویروس حامل یا امآراِناِی.
۲. مرحله پیش-بالینی شامل آزمایشهای سلولی-مولکولی و حیوانی و ارزیابی سمیت واکسن و مواد همراه آن
۳. کارآزمایی بالینی شامل سه مرحله آزمایش انسانی
۴. استانداردسازی خط تولید، ایمنی تولید، یکدستی محصول و گرفتن مجوز از نهادهای مرجع ملی و بینالمللی شناختهشده مثل سازمان غذا و داروی آمریکا یا اتحادیه اروپا برای بررسی سلامت و کارایی آن
۵. تولید انبوه، انبار کردن و زنجیرهٔ پخش
۶. نظارت مستمر بر عوارض جانبی و کارایی واکسن































