Une découverte vieille de 100 ans qui contribue toujours à l'obtention de prix Nobel

Crédit photo, Getty Images/BBC
- Author, Chris Baraniuk
- Role, BBC World Service
- Temps de lecture: 9 min
Seul dans le désert martien, un robot cherchait des réponses. En 2012, le rover Curiosity de la Nasa a ramassé un petit tas de sable, l'a ingéré et l'a bombardé de rayons X. L'intrépide robot allait découvrir de quoi était fait ce sable, ce qui pourrait à son tour révéler des informations sur la présence historique d'eau sur Mars - car toute eau dans cette plaine rouge et poussiéreuse a disparu depuis longtemps.
Près d'un siècle plus tôt, en 1915, William et Lawrence Bragg, un père et son fils, avaient remporté le prix Nobel de physique pour leurs travaux sur la cristallographie aux rayons X, une technique qui permet de déterminer les structures atomiques et moléculaires des cristaux en étudiant la façon dont les rayons X se diffractent, ou dévient, lorsqu'ils interagissent avec eux.
De nombreux matériaux, des protéines minuscules aux métaux, peuvent former des cristaux, et la cristallographie aux rayons X est devenue l'étalon-or pour révéler comment les différentes formes de matière sont assemblées.
De retour sur Terre, Michael Velbel, de l'université d'État du Michigan, attendait avec impatience les données de Curiosity sur Mars. C'était la première fois que la cristallographie aux rayons X était pratiquée sur une autre planète.
End of A lire aussi sur BBC Afrique:
« J'ai suivi la mission tout au long de son déroulement », se souvient Michael Velbel.

Crédit photo, Getty Images/BBC
Les analyses de Curiosity ont révélé des détails sur la teneur en eau des minéraux sur Mars, qui ont accrédité - sans la prouver - l'hypothèse selon laquelle la planète possédait de vastes étendues d'eau il y a seulement quelques centaines de milliers d'années.
« Nous pouvons enfin nous en rendre compte », déclare M. Velbel.
Savoir de quoi les choses sont faites nous permet de faire des choses étonnantes. L'analyse des structures atomiques et moléculaires a aidé les scientifiques à concevoir des médicaments, à percer les secrets de l'ADN et même à fabriquer de meilleures batteries.
L'importance de la cristallographie aux rayons X est évidente, car elle a joué un rôle dans l'attribution de nombreux prix Nobel - certains avancent le chiffre de plus de deux douzaines. Pourtant, peu de gens savent à quel point cette technique est impressionnante.
Modèles réguliers
Des informations vérifiées à portée de main
Cliquez ici et abonnez-vous !
Fin de Promotion WhatsApp
Beaucoup de gens m'appellent « Chrystal la cristallographe » ou « C-squared »", plaisante Chrystal Starbird, de l'université de Caroline du Nord à Chapel Hill. Elle se souvient de la première fois qu'elle a utilisé la cristallographie aux rayons X pour déterminer la structure d'une molécule. "Je regardais quelque chose que personne d'autre n'avait regardé auparavant. Je me suis dit : « C'est vraiment génial ! ».
Si vous avez déjà vu l'un de ces modèles de substances chimiques en forme de boule et de bâton, vous savez ce que recherchent les cristallographes à rayons X. Ils veulent savoir ce que sont les atomes et ce qu'ils font, ce qu'ils font et ce qu'ils ne font pas. Ils veulent savoir quels atomes sont présents dans un matériau et comment ils sont liés entre eux.
Lorsque Starbird effectue ce type d'analyse, l'une des premières étapes clés du processus consiste à prendre, par exemple, une protéine et à trouver le moyen d'en faire pousser des cristaux à très petite échelle. Tout comme l'eau forme des cristaux de glace lorsqu'elle gèle, les protéines peuvent former de très petits cristaux dans certaines conditions.
Ces cristaux sont ensuite récoltés à l'aide de minuscules boucles ressemblant à des cheveux - ce qui peut être une procédure très délicate - et placés sur un diffractomètre à rayons X. Les cristaux sont nécessaires parce que lorsque l'on observe une protéine, on ne peut pas la voir.
Les cristaux sont nécessaires car lorsque l'on fait briller des rayons X sur leur structure ordonnée, on obtient un schéma de diffraction régulier - des marques précises spécifiques à la nature chimique du cristal en question.
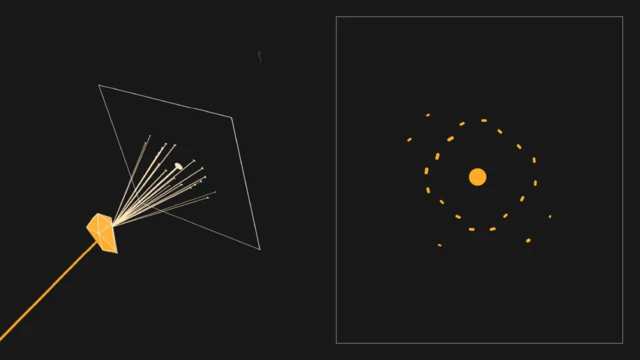
Cependant, les protéines sont beaucoup plus compliquées que les molécules d'eau et les conditions doivent donc être parfaites pour qu'elles cristallisent. Starbird devra peut-être essayer des centaines d'approches différentes - en utilisant des produits chimiques, des températures ou des niveaux d'humidité différents - avant que cela ne fonctionne.
« Je suis quelqu'un qui accepte la gratification différée », plaisante-t-elle.
Cartographie de l'insuline
Dorothy Hodgkin est l'une des scientifiques qui se serait probablement sentie concernée par cette question. Elle a passé 34 ans à utiliser la cristallographie aux rayons X pour comprendre la structure de l'insuline, à partir des années 1930. L'insuline est une hormone qui aide à contrôler le taux de sucre dans le sang, mais les diabétiques de type 1 sont malheureusement incapables de la produire.
Dans le cas de Hodgkin, l'obtention des cristaux d'insuline n'a pas été particulièrement difficile. Mais comme l'insuline contient pas moins de 788 atomes, il lui a fallu beaucoup de temps pour cartographier l'ensemble de la structure à l'aide des premières méthodes de cristallographie aux rayons X. Cette réussite a grandement facilité la production en masse d'insuline pour le traitement du diabète.
Lorsque Hodgkin a finalement terminé, en 1969, elle avait déjà remporté le prix Nobel de chimie 1964 pour ses études cristallographiques aux rayons X. Elle avait également déterminé la structure des stylos à bille. Elle avait également déterminé les structures de la pénicilline - un antibiotique important - et de la vitamine B12.

Crédit photo, Getty Images/BBC
Elle est décédée en 1994. Lors d'une cérémonie commémorative l'année suivante, Max Perutz - qui a reçu conjointement le prix Nobel de chimie pour ses travaux cristallographiques - a déclaré : « Ses caméras à rayons X ont mis à nu la beauté intrinsèque qui se cache sous la surface rugueuse des choses ». Il a fait l'éloge de sa gentillesse et de sa « volonté de fer » de réussir.
« Elle était une formidable source d'inspiration », déclare Elspeth Garman, de l'université d'Oxford, qui a connu Hodgkin.
Mme Garman décrit le diagramme de diffraction des rayons X comme « une réflexion incroyablement compliquée ». Les rayons X dirigés vers une structure cristalline interagissent avec les électrons en orbite autour des atomes à l'intérieur de cette structure et se diffractent, laissant une trace détectable sur le film photographique à rayons X (à l'époque de Hodgkin) situé à proximité.
Il en résulte un motif, que l'on peut convertir laborieusement en une carte topographique de la structure, ou en un modèle tridimensionnel.
Des femmes qui excellent
Mme Garman note que de nombreuses femmes ont excellé dans la cristallographie aux rayons X. Elle en attribue en partie la paternité aux Braggs. « Ils ont eu un arbre académique de femmes extraordinaire qu'ils ont encouragé et pris comme étudiantes diplômées alors que les gens dans d'autres domaines ne le faisaient pas », dit-elle.
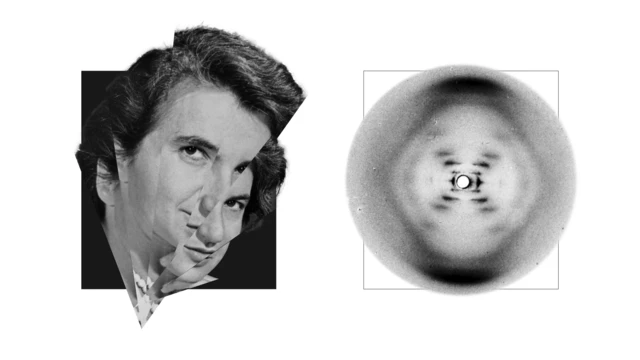
Outre Hodgkin, il y avait aussi Rosalind Franklin, dont l'image de l'ADN obtenue par diffraction des rayons X, d'une importance capitale, a été utilisée par Francis Crick, James Watson et Maurice Wilkins pour découvrir la structure complexe de l'ADN, ce qui leur a valu le prix Nobel de physiologie ou de médecine en 1962. Nombreux sont ceux qui affirment que Franklin n'a jamais été suffisamment reconnu.
Crédit photo, Getty Images/BBC
La cristallographie aux rayons X a également été impliquée dans des travaux plus récents récompensés par des prix Nobel, notamment le prix Nobel de chimie 2020 pour la technologie d'édition du génome, qui trouve son origine dans les études cristallographiques de l'ARN.
L'une des applications les plus importantes de la cristallographie aux rayons X est la découverte de médicaments. Elle a aidé les scientifiques à trouver des médicaments contre la drépanocytose et même certains cancers, par exemple.
Rob van Montfort, chef de groupe au Centre for Cancer Drug Discovery de l'Institute of Cancer Research au Royaume-Uni, explique que la cristallographie peut révéler quels composés pourraient bloquer ou contrôler des protéines clés dans le corps, et donc traiter une maladie.
« La cristallographie aux rayons X fournit des images montrant comment, exactement, le composé se lie à la molécule », explique-t-il.
Voir à l'intérieur des piles
Selon M. Garman, les récents développements technologiques ont permis des études cristallographiques de plus en plus complexes.
À la Diamond Light Source, une installation scientifique au Royaume-Uni, le personnel utilise des lignes de faisceaux de rayons X pour vérifier le potentiel médicinal des composés à grande vitesse, en analysant les sites de liaison potentiels sur une protéine donnée. « Du jour au lendemain, il est possible d'en examiner 200 », explique M. Garman. "C'est absolument stupéfiant".
Les chercheurs ont également utilisé cette approche pour étudier les matériaux des batteries, une technologie clé pour la transition vers l'abandon des combustibles fossiles. Phil Chater, chef du groupe scientifique de cristallographie au Diamond Light Source, explique que la cristallographie aux rayons X révèle comment les matériaux contenus dans les batteries peuvent se dégrader au fil du temps.

Crédit photo, Getty Images/BBC
Les batteries lithium-ion fonctionnent en permettant aux ions lithium de se déplacer entre les couches de matériau - c'est ainsi qu'elles se chargent et se déchargent en énergie.
« Le maintien de cette structure [des couches] est très important pour la durée de vie prolongée de ces batteries », explique M. Chater.
Mais la cristallographie permet parfois de voir comment les couches changent, ce qui affecte la capacité des ions à entrer et à sortir, ajoute-t-il. Les scientifiques peuvent alors chercher des moyens de résoudre le problème.
La glace de la comète à la loupe ?
La cristallographie aux rayons X a clairement fait des vagues dans de nombreux domaines. Mais il y a un éléphant dans la pièce, dit Garman.
Une technique concurrente, la cryo-microscopie électronique (cryo-EM), permet désormais aux scientifiques de déduire la structure de certaines molécules d'une manière totalement différente, en leur envoyant des faisceaux d'électrons. Certaines molécules sont traditionnellement trop petites pour être observées par les appareils de cryomicroscopie électronique, mais des solutions sont en train d'émerger dans ce domaine.
Il y a aussi l'intelligence artificielle (IA). Si l'IA peut prédire avec précision les structures moléculaires, il sera peut-être moins nécessaire de recourir à la cristallographie aux rayons X pour cette tâche. Toutefois, M. Starbird met en garde contre les nombreuses structures que l'IA ne parvient pas à prédire correctement.
« Je pense que les gens pensent à tort que la cristallographie sera bientôt terminée, parce que nous avons l'IA - nous en sommes encore loin », dit-elle.
On peut supposer que les Bragg seraient heureux d'entendre cela. Les appareils de cristallographie aux rayons X pourraient connaître d'autres aventures passionnantes à l'avenir. M. Velbel suggère d'en envoyer un sur une comète lointaine en orbite autour de notre soleil.
« Je voudrais voir à quoi ressemble la glace de la comète », dit-il, expliquant que nous pourrions trouver des mélanges intéressants de composés inhabituels si nous pouvions l'étudier de près. "Je pense que ce serait fascinant.
Ce contenu a été créé dans le cadre d'une coproduction entre Nobel Prize Outreach et la BBC.